Revista Científica PgO
ISSN 2660-7182
Efecto antibacteriano de G-CAM. Estudio experimental in vitro
Artículo de Investigación Original | Revista PgO UCAM: 2022 :31
Intro
Actualmente el clínico se encuentra en una búsqueda constante de materiales bioinspirados, es decir materiales que imiten las propiedades físicas y químicas de la naturaleza, con el objetivo de evaluar, tratar, aumentar y/o de devolver lo que se perdió. Cuando hablamos de biomateriales debemos tener en cuenta que nos referimos a materiales no biológicos, y tal como platearon Wataha y Hanks en 1998, no pueden considerarse sustancias inertes, ya que generan una respuesta al interactuar en el medio oral. Lo que se busca es que estos materiales respondan de la misma manera a cómo lo haría el tejido vivo, por lo que deben ser materiales biocompatibles. Williams en 1987 definió biocompatibilidad como “la habilidad de un material para promover una respuesta biológica apropiada, dentro de su aplicación específica”. (1)
Para que un material se considere biocompatible debe pasar distintas pruebas, entre las que destacan:
- Pruebas de hemolisis: evalúan la presencia de toxinas liberadas por los materiales y que pueden producir descomposición prematura de glóbulos rojos, dificultando el transporte de oxígeno a los tejidos.
- Las pruebas de AMES para evaluar el potencial mutagénico de compuestos químicos.
- STYLES para medir el potencial de mutación celular de un material y el grado de transformación celular respectivamente. (2)
Otro factor a evaluar es la toxicidad, que ocurre ante exposiciones muy altas del material, o por exposiciones continuas en dosis medias-altas. Por otro lado, aparecen alergias, es decir, respuestas inmunológicas como consecuencia de una exposición continua a concentraciones bajas. (3)
En odontología, el material más usado históricamente es el PMMA, el cual presentan diversas desventajas: es duro, frágil, con baja resistencia al impacto y baja resistencia a la flexión, lo que deriva en formación de grietas y fracturas cuando soportan esfuerzos mecánicos, rápido desgaste, pérdida progresiva de sus propiedades mecánicas con el tiempo, cambios de color y adhesión de placa bacteriana debido a su alto coeficiente de absorción de agua.
Gracias a la nanotecnología, es decir, la modificación de la estructura molecular de los materiales para cambiar sus propiedades intrínsecas y obtener otros con aplicaciones revolucionarias, se abre un abanico de posibilidades que permite trabajar a nivel molecular, cambiar propiedades, mejorar cualidades de los materiales, ampliar las posibilidades de tratamiento y hacerlos más predecibles. De esta manera, aparece un nanomaterial revolucionario en odontología: el grafeno. (4)
El grafeno es una forma alotrópica del carbono; puede definirse como un material bidimensional en el que los átomos de carbono se unen mediante enlaces sp2 para formar una red hexagonal con estructura semejante a la de un panal de abeja. El grafeno se puede extraer del grafito por simple exfoliación, pero también puede conseguirse a partir de diversas fuentes basadas en el carbono. La producción del grafeno depende del método utilizado para sintetizarlo. Cuanto más puro se desee obtener el grafeno, es decir, de mayor calidad, el proceso será más complicado, la cantidad obtenida más pequeña y el coste más alto. Por eso la producción de grafeno siempre ha estado restringida a nivel de laboratorio. (5)
Tiene una resistencia 200 veces superior al acero, el grosor de 1 átomo lo que le confiere flexibilidad muy elevada, es estable y capaz de formar reacciones químicas con otras sustancias para formar así nuevos compuestos, es biocompatible y capaz de mejorar la adherencia celular de osteoblastos y células mesenquimales (células madres, multipotenciales) (66).
Además, el grafeno ofrece características únicas como gran superficie, alta estabilidad en ambiente fisiológico, propiedades antimicrobianas, y antimicóticas (7) También puede ser utilizado como agente antibacteriano, ya que tiene propiedades de inhibición de crecimiento de bacterias, evita la absorción de líquidos y capacidad bacteriostática y antifúngica. (4,7)
Diversos estudios están enfocados a demostrar que recubrir las prótesis de grafeno mejora las propiedades superficiales mecánicas; incluso sustentan que el grafeno puede acelerar y mejorar la osteointegración y la cicatrización. Un estudio de Rueda et al. concluyó que el recubrimiento de grafeno favoreció el crecimiento celular y la adhesión celular a los poros del sustrato. (8)
Otro estudio similar demostró que las membranas GO-Ti estimulaban significativamente la actividad de la fosfatasa alcalina (ALP), las membranas GO-Ti se usaron en el procedimiento de regeneración ósea guiada para el tratamiento de defectos óseos de ratas y se observó que las membranas GO-Ti conducen a una mejor regeneración ósea en comparación con el grupo control (membranas de titanio) (6). En otro estudio se hicieron cultivos de fibroblastos gingivales humanos (hGF), células madre derivadas de tejido adiposo humano (hASC) y células madre mesenquimales de médula ósea humana (hBMMSC) en muestras de grafeno; este estudio fue realizado in vitro e in vivo, para determinar los efectos del recubrimiento de grafeno sobre el implante de titanio en la adhesión, la proliferación y la diferenciación osteogénica. Se observó que el grafeno aumenta la adhesión de hASC y hBMMSC al sustrato, por lo que el recubrimiento de grafeno sobre sustratos de Ti podría mejorar la interacción entre el material y el tejido blando circundante. 16)
Los materiales al ser bioinertes tienen la desventaja de que se les adhiere la placa bacteriana, por ende trae consigo la interacción de la virulencia de las bacterias y una serie de factores específicos e inespecíficos y es aquí donde nace la importancia tener un material antibacteriano, antibacteriostático y antimicótico.(6)
Pandit et al. (9) sustentaron que ante bacterias como Escherichia Coli la mayor parte del efecto bactericida se observa en las primeras cuatro horas de interacción con derivados del grafeno (GO). La actividad antimicrobiana de las nanohojas de grafeno se observó incluso más eficaz que el antibiótico estándar kanamicina. Sin embargo, la eficacia antimicrobiana variaba con las diferentes especies bacterianas. Las nanohojas de grafeno sintetizadas por método hidrotermal en condición alcalina exhibieron una excelente actividad antibacteriana contra E. coli, Salmonella typhimuirum (S. typhimuirum), Bacillussubtilis (B. subtilis), y Enterococcus faecalis (E. faecalis). La actividad antimicrobiana de GO se demostró aún más probando su efecto bactericida contra patógenos dentales, incluidos Streptococcus mutans (S. mutans), Fusobacterium nucleatum (F. nucleatum) y Porphyromonas gingivalis ( P. gingivalis). Li et al. usaron películas de grafeno monocapa fabricadas sobre sustratos conductores, semiconductores y no conductores y su actividad antimicrobiana fue examinada contra E. coli y Staphylococcus aureus (S. aureus). Sus resultados mostraron que la actividad antibacteriana del grafeno prístino solo se puede obtener cuando el sustrato conductor está debajo. (9)
Se ha demostrado que los bordes finos y afilados de los derivados del grafeno desgarran la membrana celular bacteriana para inactivar las células bacterianas al salir de los materiales intracelulares. Además, las células que quedan atrapadas en láminas de grafeno quedan totalmente aisladas del entorno externo debido al bloqueo del intercambio de gases / iones / nutrientes. Este atrapamiento evita la proliferación de células microbianas y su inviabilidad por falta de nutrientes y actividad respiratoria. (10)
Con estos excelentes fenómenos probados, la actividad de investigación reciente se está enfocando hacia el desarrollo de composites incorporando grafeno.
La incorporación de grafeno en ciertos materiales permite obtener un material combinado con propiedades mejoradas. Un ejemplo de ello es la incorporación industrial de óxido de grafeno en metacrilato de metilo para generar un polímero (PMMA) mejorado, no solo desde el punto de vista mecánico, sino también una notoria ventaja en la respuesta biológica de los tejidos blandos. (11)
De acuerdo con lo anteriormente expuesto, se realizó en el presente estudio la prueba de reversión de mutaciones bacterianas (Bacterial Reverse Mutation Test) (12), para evaluar el efecto citotóxico de la Salmonella entérica y Escherichia coli.
Salmonella entérica es uno de los agentes más relevantes debido a su impacto en la salud pública y la sanidad animal, tanto en países desarrollados como en vías de desarrollo. En este sentido, Salmonella es el agente etiológico bacteriano más frecuente en los brotes transmitidos por alimentos (13). La Salmonella es un bacilo Gram negativo que se comporta como anaerobio facultativo. Está presente en el intestino de personas y animales sanos, se transmite por la ruta fecal-oral, directamente, o bien indirectamente, a través de alimentos. Es capaz de sobrevivir la acidez del estómago y la alta osmolaridad del intestino delgado, induce su internalización por las células epiteliales intestinales del íleon y resiste la fagocitosis mediada por las células dendríticas y macrófagos, logrando colonizar el tejido linfoide subyacente y los ganglios linfáticos mesentéricos (14).
La Salmonella entérica contiene las subespecies: Salmonella enterica subsp. enterica (I), Salmonella enterica subsp. salamae (II), Salmonella enterica subsp. arizonae (IIIa), Salmonella enterica subsp. diarizonae (IIIb), Salmonella enterica subsp. houtenae (IV) y Salmonella enterica subsp. indica (VI), mientras que la especie S. bongori (V) no posee subespecies asociadas, siendo esta originalmente clasificada como subespecie de S. entérica, y por eso mantiene la denominación “V” (13).
Las salmonellas se pueden multiplicar en diversas condiciones ambientales: fuera de los anfitriones en que viven, crecen en el rango de temperatura de 5 a 47 °C, siendo 35 a 37 °C su óptima, sobreviven a un pH en rangos de 4-9 y una actividad acuosa de 0,94-0,99. Las Salmonella es sensible al calor y con frecuencia mueren a temperatura de 70 °C o superior, una inhibición completa del crecimiento ocurre a < 7 °C, pH 3,8 y actividad acuosa de 0,94.(15)
Salmonella tiene capacidad de formar biopelículas sobre diferentes tipos de superficies inertes y vivas; esta habilidad contribuye a su supervivencia. Las biopelículas son una agregación de microorganismos rodeadas por una matriz que está compuesta por una mezcla de sustancias extracelulares poliméricas (SEP). Esta matriz está formada por 97% de agua y el resto son exopolisacáridos, proteínas, lipopolisacáridos, ácidos nucleicos y ácidos grasos. (16)
Las biopelículas modifican aspectos esenciales de la capacidad infectante bacteriana y han estado aumentando progresivamente su impacto en la generación de problemas de salud serios y persistentes. La formación de biopelículas le permitiría a Salmonella sobrevivir a largo plazo en el entorno de las granjas de aves de corral y contaminar la carne y huevos o alimentos derivados, los que siguen siendo vehículos principales de los brotes de salmonelosis de origen alimentario. (13)
La resistencia antimicrobiana es considerada una amenaza creciente globalmente debido a la gran diversidad y volumen de antimicrobianos prescritos en medicina humana y animal. Diversos factores han contribuido a este fenómeno: la prescripción a veces innecesaria de antimicrobianos, la automedicación, y el mal uso de estos fármacos como promotores del crecimiento en la industria animal. (17)
Con la denominación Escherichia coli verotoxigénicos (ECVT) se conocen todas aquellas cepas de E. coli capaces de producir alguno de los tipos existentes de una potente citotoxina conocida como verotoxina (VT). Existen 2 tipos principales de VT, denominados VT1 y VT2, atendiendo a diferencias en su secuencia aminoacídica y en su reactividad inmunológica.(18)
Tras la entrada de la bacteria por vía oral, la resistencia demostrada de los ECVT al ácido, facilita su supervivencia en el estómago, desde donde progresa a través del intestino delgado hasta alcanzar el colon, considerado como el principal lugar de colonización de los ECVT en los seres humanos, junto con la parte más distal del intestino delgado. Una vez alcanzado el colon la bacteria se adhiere íntimamente a la membrana de las células epiteliales, dando lugar al borrado o destrucción localizada de las microvellosidades, suficiente para provocar la aparición de diarrea no sanguinolenta. Si se produce suficiente cantidad de toxina en el intestino esta desencadena una isquemia mesentérica, consecuencia del daño ejercido sobre los vasos sanguíneos locales, que provoca que la diarrea acuosa existente evolucione hacia un cuadro de CH, con evidencias histopatológicas de edema y hemorragias en la lámina propia del tubo digestivo. (18)
Dado que la cavidad oral es un medio séptico, desde el cual puede producirse la diseminación bacteriana al resto del organismo, el objetivo del presente trabajo fue analizar si los discos G-CAM son capaces de inhibir el crecimiento bacteriano.
Material
Test de Ames
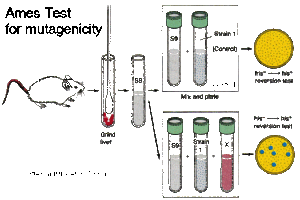
Bruce Ames desarrolló un ensayo para identificar mutágenos potenciales en el año de 1928. Esta prueba funciona con bacterias mutantes y busca químicos que puedan cambiarlas para que de nuevo sean bacterias normales o regresen a su estado original (19).
En la prueba, un mutágeno potencial Salmonella typhimurium es colocado en un papel de disco en el centro de una caja de Petri sobre el cual sólo células bacterianas que mutan son capaces de crecer (se ocupan bacterias debido a que han probado ser buenos modelos para determinar el potencial mutagénico de los compuestos). El potencial mutagénico del compuesto es determinado por la cantidad de aumento en el crecimiento bacteriano (23).
Investigadores han manipulado células de ratón para hacerlas blancos para carcinógenos y han pasado genes de células cancerígenas a ratones saludables, lo cual ha lleva a la conclusión de que las mutaciones en genes específicos pueden provocar los cambios para generar el cáncer.(21)
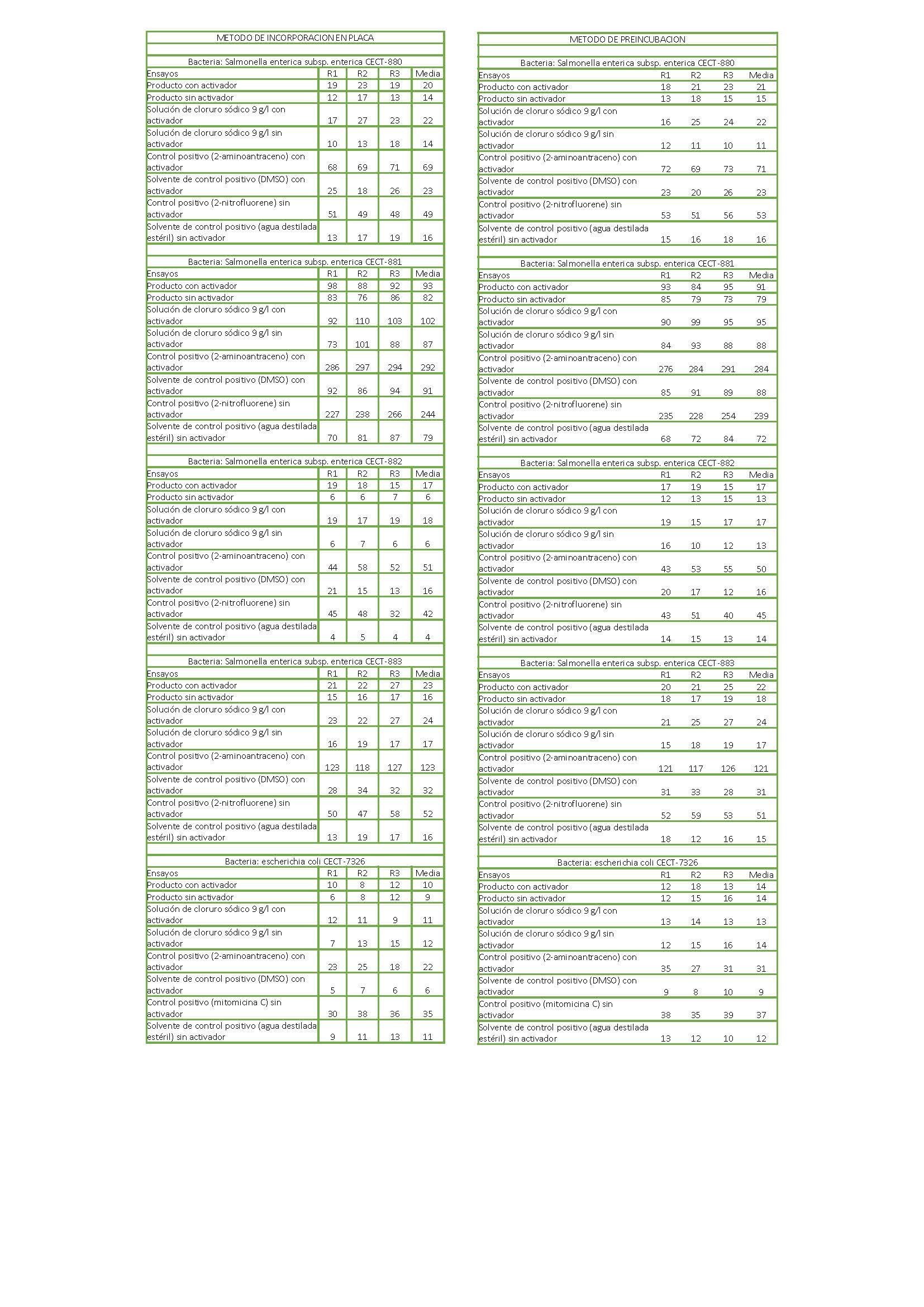
Prueba de reversión de mutaciones bacterianas (12)
Numero de lote: del disco GCAM L18091120026
Productos químicos:
Controles positivos utilizados:
- 2-Nitrofluoreno.
- Cumene hydrogen peroxide.
- Mitomicina C.
- 2-Aminoantraceno.
- Azida de sodio.
Controles negativos utilizados:
- Dimetilsulfóxido (DMSO).
- Agua destilada estéril.
- Solución de cloruro sódico 9g/L.
Materiales biológicos usados:
Microorganismos utilizados:
- Salmonella enterica subsp. enterica CECT-880.
- Salmonella enterica subsp. enterica CECT-881.
- Salmonella enterica subsp. enterica CECT-882.
- Salmonella enterica subsp. enterica CECT-883.
- Escherichia coli CECT-7326.
Condiciones experimentales
Periodo del análisis: 1 mes de análisis
Dispositivo estéril / esterilizado en el laboratorio: Estéril.
R1 Número de réplicas realizadas con el producto: 3 (triplicado).
R2 Número de réplicas de los controles positivos: 3 (triplicado).
R3 Número de réplicas de los controles negativos: 3 (triplicado).
Materiales de ensayo y preparación de las muestras
9 muestras de GCAM.
Placas Petri de 90 mm.
Para las pruebas de mutagenicidad, se utilizarón las siguientes condiciones:
Tiempo de incubación previa de los microorganismos: 24 horas.
Periodos de observación tras la exposición: 48 horas.
Temperatura de trabajo: 37 ºC
Temperatura ambiental (mínima/máxima): 17,5ºC/19,8ºC
Humedad relativa (mínima/máxima): 45%/Max 52%
Medio de extracción: Solución de cloruro sódico 9g/L.
Método de extracción: Producto de ensayo en agitación en solución salina a + 37ºC ± 1ºC durante 72 horas.
Proporción producto/volumen de medio de extracción: 0,2 g/mL se diluyeron 100 mg de cada compuesto de prueba.
Prueba de mutagenicidad
Las cepas de los microorgamismos pertenecen al Instituto Valenciano de Microbiología, S.L.
El método de ensayo y su validación se realizó de acuerdo con las directrices de la norma UNE-EN-ISO 10993-3: 2014 y OECD 471: 1997 (Procedimiento interno TOXICOL/EVADISP-0930). Procedimiento por exposición a extracto del dispositivo. Norma UNE-EN ISO 10993- 12:2012.
Métodos cuantitativos para la evaluación de la genotoxicidad
Revertantes inducidos
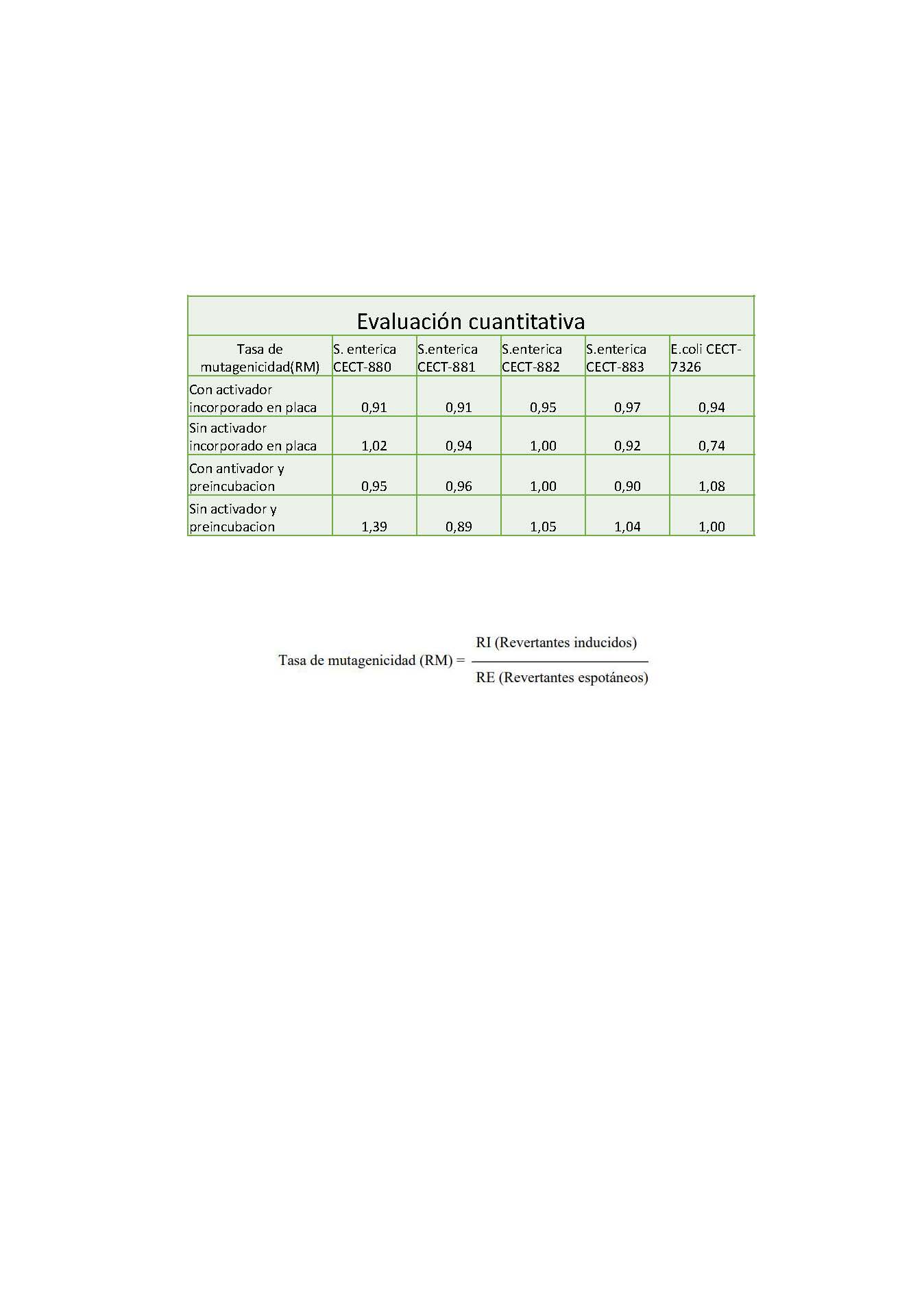
Tasa de mutagenicidad (RM) = ———————————
Revertantes espotáneos
Para que una muestra se considere mutagénica, la tasa de mutagenicidad debe ser ≥ 3.
Observaciones especiales relevantes durante la prueba (12)
Para realizar el ensayo no fue necesario fraccionar el producto.
Los resultados son expresados cuantitativamente a través del número de revertantes por mL de muestra en la placa. Los resultados son también expresados a través de la razón de mutagenicidad (RM) que es una razón entre el número de revertantes de la placa de prueba (revertantes espontáneos inducidos) y el número de revertantes en la placa control (revertantes espontáneos) (Anexo 1).
Una muestra es considerada positiva cuando existe una relación dosis respuesta entre las concentraciones probadas y el número de revertantes inducidas en por lo menos una dosis, considerando que la RM es igual o superior a 3, a fin de asegurar una significancia de la prueba.
Resultados
No se observa mayor crecimiento en los cultivos de la muestra a las 48 horas, en comparación con los controles. El número de colonias viables no varía respecto a los controles. No se observa un aumento del crecimiento durante el tiempo de incubación en presencia del dispositivo. La tasa de mutagenicidad (RM) del producto recibido es inferior a 3. 13.
Por tanto, la exposición de las cepas bacterianas al producto sanitario Disco Acrílico, lote no indicado, no posee efecto genotóxico cuando se ensaya según las condiciones citadas.
Discusión
Uno de los grandes desafíos en odontología es el control de la presencia de bacterias que podrían complicar afectar a la salud sistémica de pacientes con periodontitis o procesos infecciosos, induciendo septicemias en pacientes inmunosuprimidos, pudiendo infectar prótesis valvulares y/o articulares, o inducir el nacimiento de niños de bajo peso, entre otras. (22)
En odontología existe una búsqueda constante de mejorar las cualidades antimicóticas y antimicrobianas de los materiales. Lee et al. en su estudio de 2018 demostraron que agregar nanopartículas de grafeno al PMMA aumentaba su rugosidad y su hidrofilicidad, sin afectar a la dureza ni flexión, resultando un material prometedor en prótesis removible, aparatología ortodóntica o materiales restauradores, dada su capacidad antimicrobiana (21).
Pranno et al. (23) llevaron a cabo un tratamiento de superficie de implantes con grafeno y concluyeron que minimiza la adhesión bacteriana e inhibe el biofilm. Un estudio similar de Qian et al. (24) creó periimplantitis artificialmente en la boca de perros Beagle. Los autores concluyeron que utilizar óxido de grafeno en los aditamentos implantarios ayuda a eliminar las bacterias y, por tanto, favorece la salud de los tejidos periimplantarios. De acuerdo con los resultados del presente estudio, el grafeno cumple con este propósito: se evaluaron discos de PPMA dopados con Grafeno, tuvieron un periodo de exposición de 24 horas a las bacterias: Salmonella enterica subsp. enterica y Escherichia coli, pasada la exposición no se observa mayor crecimiento en los cultivos de la muestra a las 48 horas, en comparación con los controles. El número de colonias viables no varió respecto a los controles, tampoco se observó un aumento del crecimiento durante el tiempo de incubación (22). La tasa de mutagenicidad del producto recibido es inferior a 3.13, por lo que podemos concluir que la exposición de las cepas bacterianas al producto sanitario Disco G-CAM no posee efecto genotóxico.
Conclusiones
En implantología existen diversos factores que condicionan el éxito del tratamiento, como el consumo de tabaco, la calidad ósea, los factores sistémicos, el trauma quirúrgico, etc.; uno de los factores más importantes es el control bacteriológico; antes durante y después de la cirugía puesto que de este depende la correcta osteointegración.
En el estudio realizado no se observa mayor crecimiento bacteriano en los cultivos de la muestra a las 48 horas, la tasa de mutagenicidad del producto estudiado es inferior a 3. 13 tanto en cuanto podemos decir que no posee efecto genotóxico cuando se ensaya según las condiciones citadas, esto nos abre un abanico de posibles estudios basados en grafeno; que acelera la osteointegración mejorando así la cicatrización de los tejidos, buscando el material más estable y biocompatible con el sistema estomatognático.
Bibliografía
- Buenahora MR, Guzman H. BIOCOMPATIBILIDAD Y CITOTOXICIDAD. Sociedad Colombiana de operatoria y biomateriales. Oct 200732. Restrepo Ospina DP, Ardila Medicina CM.
- Ríos V, Romero N, Valencia C, Balanta J. Métodos para determinar la biocompatibilidad en materiales dentales. Rev. Estomatol. 2014,22(2): 7-12.
- Restrepo Ospina DP, Ardila Medicina CM. Reacciones adversas ocasionadas por los biomateriales usados en prostodoncia. Avances en odontoestomatología. Vol.26- Núm.1-2010
- Amudha K, Usha G, Arthiseethalakshmi S, Salooqa M. The revolutionary era of Graphene in Dentistry – a review.Vol 6. Oct 2016
- Mora K, Boquete A, Martínez J. La nanotecnología del grafeno aplicada a la odontología, nuevos materiales bioinspirados en la naturaleza. El dentista moderno. Abril 2020.
- Gago I, Molina I, León G, Miguel B. Introducción al estudio de las propiedades antibacterianas del grafeno. Revista de Pensamiento Estratégico y
- Camacho E. “Simulación computacional 3D mediante el método de elementos finitos para recubrimiento superficial con grafeno a implantes dentales de Titanio”. Memorias del XXVI congreso internacional anual de la SOMIM.2020.
- Rueda Flores Ana. Mejora de la osteointegración de piezas de titanio poroso: influencia del tipo de tratamiento de modificación superficial. Dpto. de Ingeniería y Ciencia de los Materiales y del Transporte Escuela Técnica Superior de Ingeniería Universidad de Sevilla Sevilla, 2021
- Pandit S, Gaska K, Kádár R, Mijakovic I. Graphene-Based Antimicrobial Biomedical Surfaces Chemphyschem. 2021 Feb 3;22(3):250-263. doi: 10.1002/cphc.202000769.
- Elias L, Taengua R, Frígols B, Salesa B, Serrano-Aroca A. Carbon Nanomaterials and LED Irradiation as Antibacterial Strategies against Gram-Positive Multidrug-Resistant Pathogens. Int J Mol Sci. 2019 Jul 23;20(14):3603. doi: 10.3390/ijms20143603
- Rodríguez A, Curto M, Sario F, Sánchez J, Panaino I, Garrofe A. El grafeno en la rehabilitación bucal y si comportamiento biológico. Caso Clínico. Cátedra Materiales Dentales, Facultad de Odontología, UBA
- Prueba de reversión de mutaciones bacterianas (Bacterial Reverse Mutation Test) – Normas ISO 10993-3: 2014 (Biological Evaluation of Medical Devices, Part 3: Test for Genotoxicity, Carcinogenicity and Reproductive Toxicity) y OECD 471: 1997 (Bacterial Reverse Mutation Test) . Instituto Valenciano de Microbiología.
- Ramsés Alfaro-Mora, Aspectos relevantes sobre Salmonella sp en humanos, Revista Cubana de Medicina General Integral. 2018;34(3)
- Barreto M, Castillo-Ruiz M, Retamal P. Salmonella entérica: una revisión de la triologia agente, hospedero y ambiente, y su trascendencia en Chile. Infectología al día. Sep 2015
- Muñoz E. El grafeno: química y aplicaciones. Instituto de Carboquímica ICB-CSIC. Boletín Grupo Español Carbón nº 41. Septiembre 2016.
- Rodríguez C, Vasilievna O. Propiedades y aplicaciones del grafeno.Facultad de Ciencias Físico- Matemáticas, UANL . Ingenierías, 2008
- Ardila Medina CM. Efecto de las enterobacterias en pacientes con periodontitis crónica. Av Periodon Implantol. 2010; 22, 1: 27-35
- Sergio Sánchez, Remigio Martínez, Juan Manuel Alonso y Joaquín Rey. Aspectos clínicos y patogénicos de las infecciones por Escherichia coli O157:H7 y otros E. coli verotoxigénicos. Enfermedades infecciosas y microbiología clínica, ISSN 0213-005X, Vol. 28, Nº. 6, 2010, págs. 370-374
- Rodríguez, E; Gamboa, M; Hernández, F; García, J. 2005. Bacteriología general: Principios y Prácticas de Laboratorio. Editorial Universidad de Costa Rica. 363-365 pp.
- Li, J., Wang, G., Zhu, H., Zhang, M., Zheng, X., Di, Z., Liu, X., & Wang, X. (2014). Antibacterial activity of large-area monolayer graphene film manipulated by charge transfer. Sci Rep 4, 4359 (2014). https://doi.org/10.1038/srep04359
- Lee, J. H., Jo, J. K., Kim, D. A., Patel, K. D., Kim, H. W., & Lee, H. H. (2018). Nano-graphene oxide incorporated into PMMA resin to prevent microbial adhesion. Dent Mater. 2018 Apr;34(4):e63-e72. doi: 10.1016/j.dental.2018.01.019.
- Schweikl H, Schmalz G, Göttke C. Mutagenic activity of various dentine bonding agents. Biomaterials. 1996 Jul;17(14):1451-6. doi: 10.1016/0142-9612(96)87289-9.
- Pranno, N., La Monaca, G., Polimeni, A., Sarto, M. S., Uccelletti, D., Bruni, E., Cristalli, M. P., Cavallini, D., & Vozza, I. (2020). Antibacterial Activity against Staphylococcus Aureus of Titanium Surfaces Coated with Graphene Nanoplatelets to Prevent Peri-Implant Diseases. An In-Vitro Pilot Study. Int J Environ Res Public Health. 2020 Feb 29;17(5):1568. doi: 10.3390/ijerph17051568.
- Qian, W., Qiu, J., & Liu, X. (2020). Minocycline hydrochloride-loaded graphene oxide films on implant abutments for peri-implantitis treatment in beagle dogs. Journal of periodontology, 91(6), 792–799. https://doi.org/10.1002/JPER.19-0285